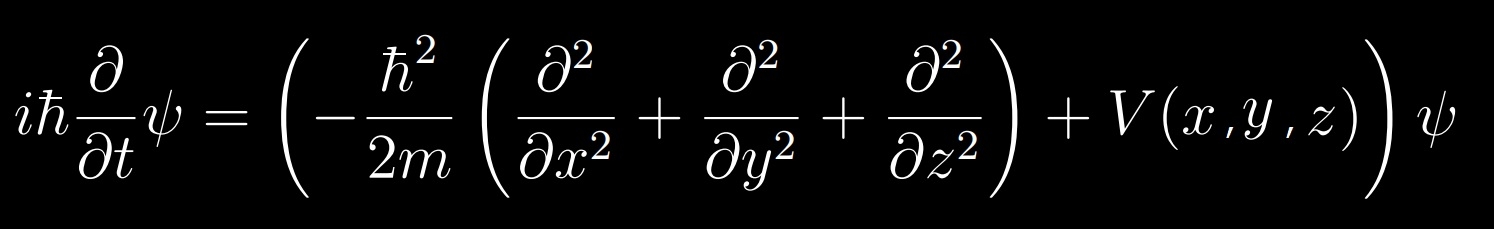
化学系理論物理学
量子化学とは量子力学を用いて化学を扱う学問とされる。
量子力学は、我々が作成した資料「量子力学 シュレディンガー方程式」と「量子力学 行列力学」で説明した通り完全に物理学とは関係のない無意味な文字や記号の羅列でしかない。
量子化学について具体的に考察を行う。
シュレディンガー方程式と呼ばれる関数に対して物理学的対象に応じて式の形を調整し未知関数φを求めることで原子や分子を表現可能と主張している。
「シュレディンガー方程式」
r:r(x,y,z), i:虚数単位 ,V(r):対象のエネルギー
この式は物理式の条件を全く満たしていないのでこれを物理学式と主張することは完全に不正である。
未知関数である波動関数φ(t,x,y,z)に関して、この未知関数を複雑な微分方程式を解いて確定させるのは不可能である。
詳しくは「量子力学 シュレディンガー方程式」を参照のこと。
3[kg]+5[m]=8[m/s]
が無条件で絶対に正しくないことは小学生でも理解できるし、また理解すべき事項である。
左辺は [φ/s]
右辺第一項は [φ/kg/s2]
右辺第二項は [φNm]
となるのでこの式は無条件で全宇宙において完全に物理式としては不正であり、物理学的な意味を持たない記号の羅列となる。
実際には微分方程式は解けないので波動関数φは確定しない。
ここでは捏造された水素原子の波動関数φを分析する。
同じく捏造されたEはn,m,lの整数で形式が決まるとされる。
極座標(角θ、角Φ、動径r)で波動関数は
φ=f(n、m、l、θ、Φ、r)Exp(ーr)と表わさられる。
f(n、m、l、θ、Φ、r)は複雑な関数であり、Exp(ーr)はrが増加するにつれて0に近づく関数である。
つまり、f(n、m、l、θ、Φ、r)がどんな関数であれ、rが増加するとφは0に近づくことになる。
イラスト
φが電子の存在確立を表すという設定と良く辻褄があっており本当であるような印象を与えることに成功している。
電子の存在確立を表しているされるが非常に漠然と定義されているだけであり、これは致命的に悪い問題である。
具体的に水素の φ(θ、Φ、r)の値が求まりそれが電子の存在確立を表わすとされるが、化学実験の結果や電子顕微鏡による観測は全て共有電子はある狭い範囲に常に留まることを示しており完全に矛盾する。また、大きいrに対しても存在確立φはゼロにならず明らかに矛盾する。
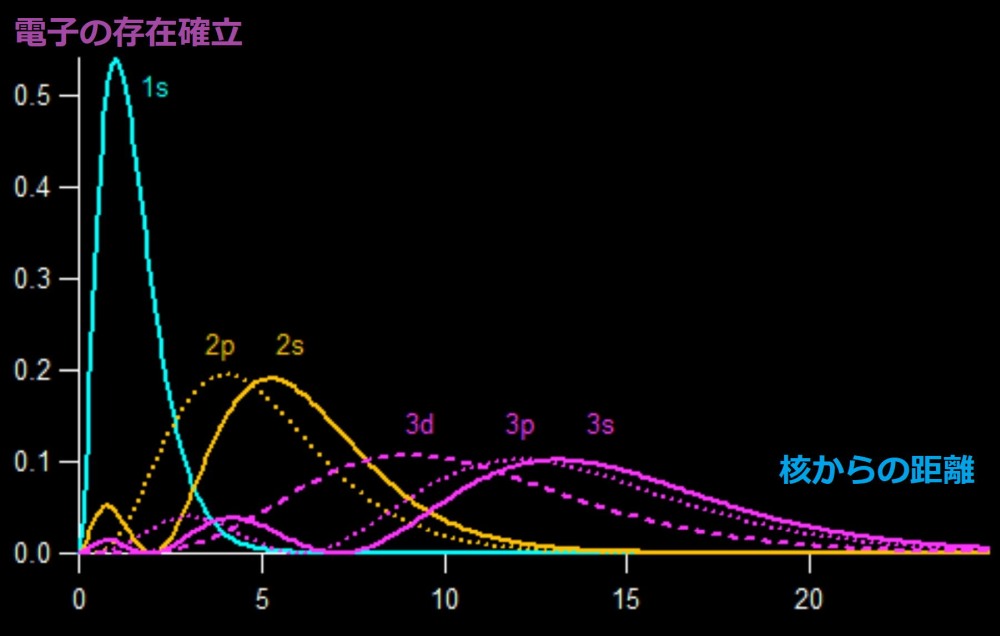
「電子の距離と存在確立」
(1,2,3はnで、s、p、dはlで決まる。)

「水素の基本状態の電子分布図」
整数n:
主量子数でエネルギー順位を表すとされるが水素を含む全原子で電子の励起状態は一切確認されていない嘘、捏造、デタラメである。
整数m:
磁気量子数で磁気に関することを表すとされる。基のシュレディンガー方程式には磁気に対応する部分が全くないのに関わらず磁気に関する量が現れるのは魔法としか表現しようがない。電子の存在確立から磁気が現れるのは完全に不可解であり、当然に嘘、捏造、デタラメである。
整数l:
方位量子数で角運動量を表すとされる。電子の存在確立と角運動量は矛盾する。当然に嘘、捏造、デタラメである。
水素様原子とは原子核の陽子数が1より大きい整数Zで、核の周りに電子(Z-1)個が雲の様に広がり1個の電子のみが自由に動き回るモデルである。水素原子と同様にシュレディンガー方程式は厳密に解けて、解は水素の場合とほぼ同じとされる。
水素原子と同様にただ単にデタラメである。
水素分子は二つの水素原子から構成される最も単純な分子である。
二つの電子は核AとBの中間点で電子ペアを構成して、核A及び核Bとの距離をほぼ一定に保っており、電子は極めて限定された範囲に拘束されていると実験により強く推測されている。
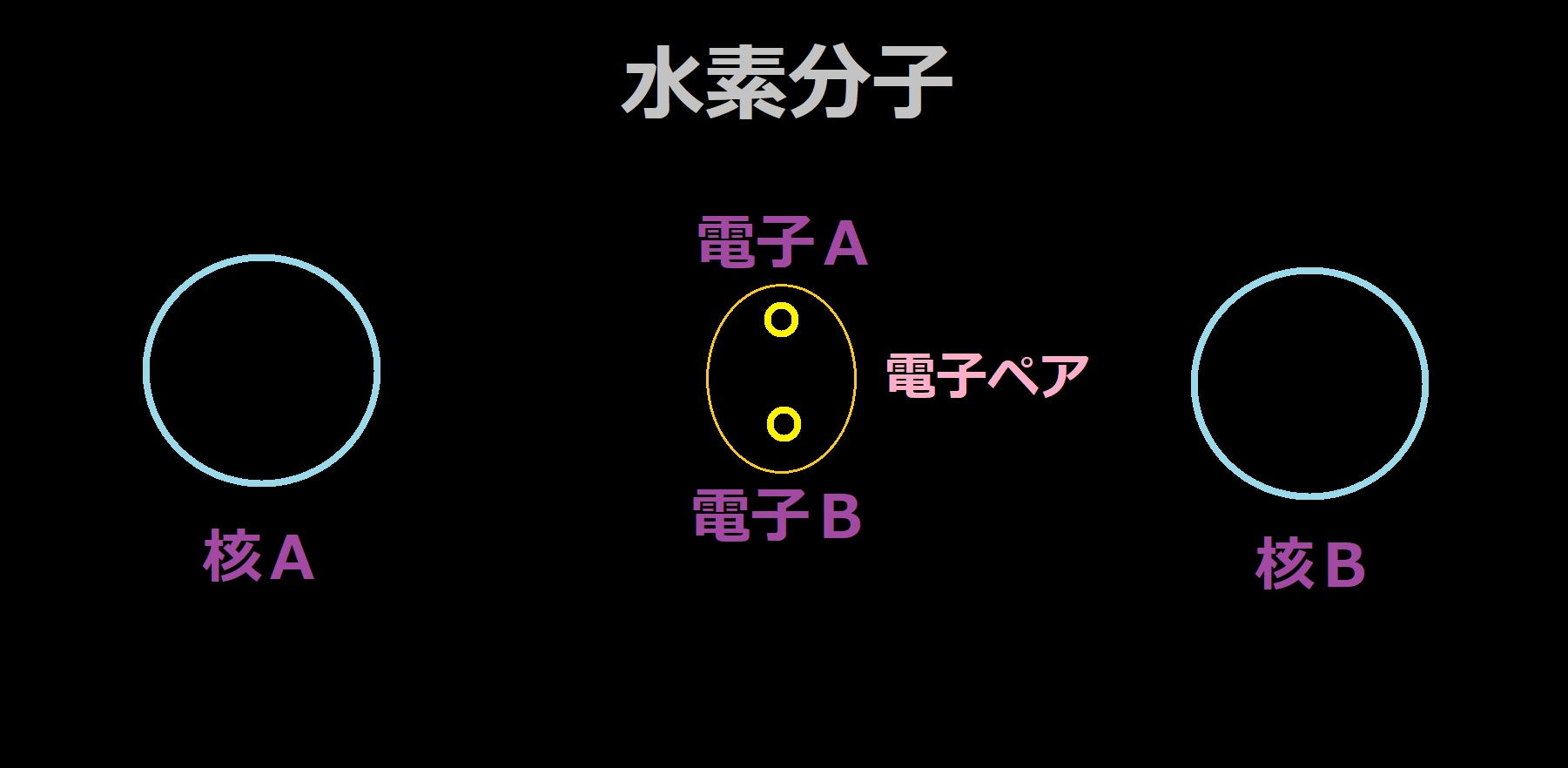
共有結合をする原子のことであり、水素原子も含まれる。
共有結合とは、原子間で電子対の共有をともなう化学結合である。
電子ペアが構成される理由が理解できなければ共有結合を正常に説明できない。現在までその理由は不明である。
対象が核A、核B、電子A,電子Bの四つであり、4体問題として考える必要がある。電子Aと電子Bは水素分子内では核Aと核B両方に所属する。
図の通り6通りの相互作用を最低でも考える必要がある。
重力は非常に小さいので無視するとして、核A、核B、電子A,電子Bが放出する電場と磁場を考慮し、二つの力と6通りの対象で常に12通りの相互作用の計算が必要である。
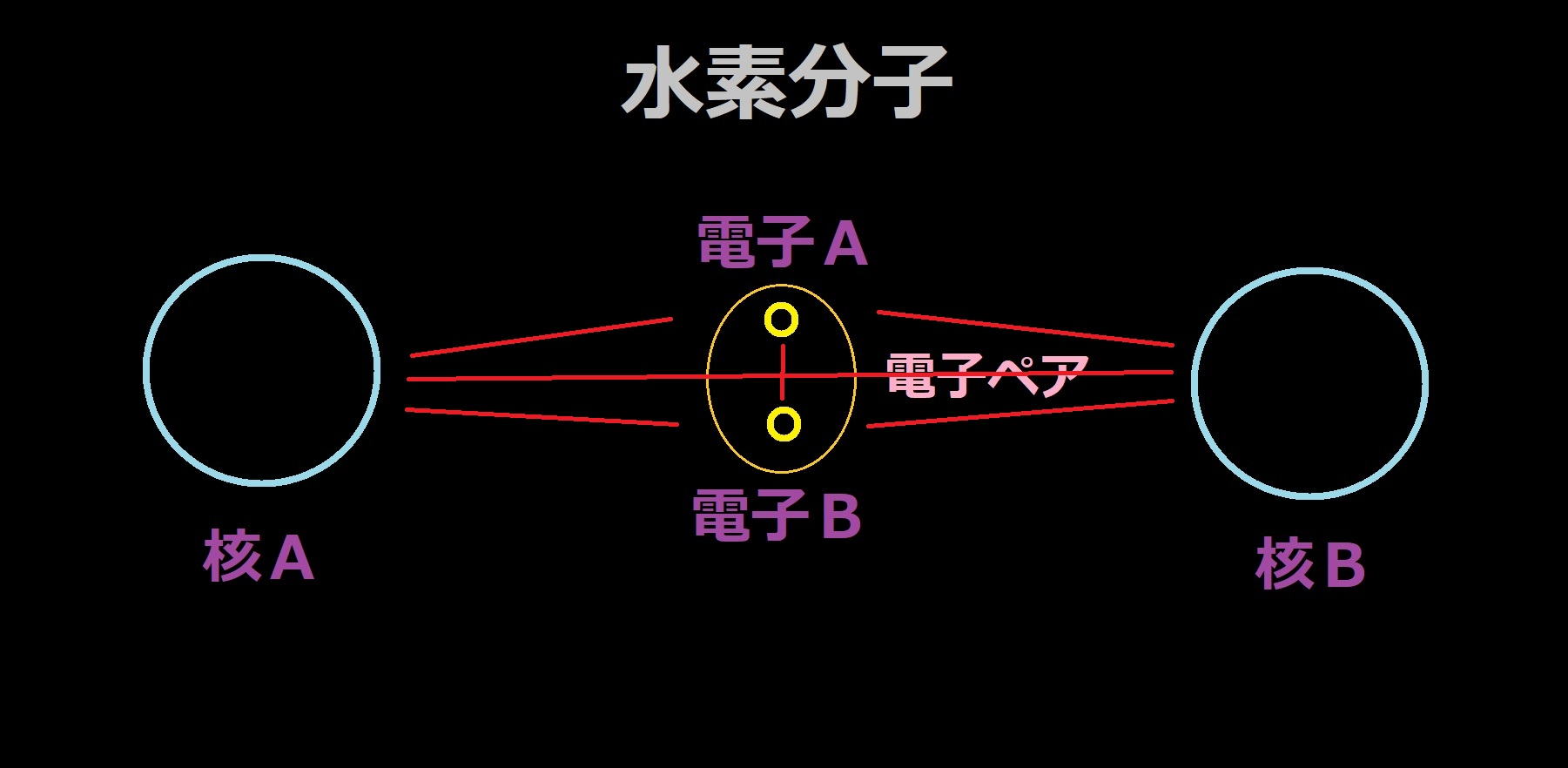
rA=r(xA,yA,zA)
rB=r(xB,yB,zB)
核Aと電子Aの水素原子の波動関数をφA
核Bと電子Bの水素原子の波動関数をφB
とする。
ほとんどがこのパターンである。
電子対に関する項はない。
水素分子のエネルギーV=V(rA)+V(rB)
水素分子のφ=C1φA+ C2φB (C1,C2:定数)
解説:

核Aと電子A、核Bと電子Bの相互作用のみを考えている。これが水素分子を表現できるはずがない。
結論:
極めて幼稚な嘘、作り話、デタラメである。
電子Aと電子Bの相互作用を表わす未知関数をVee(rA,rB)とする。
水素分子のφ=C1VeeφA+ C2VeeφB (C1,C2:定数)
解説:

核Aと電子A、核Bと電子Bの相互作用のみを考えている。これが水素分子を表現できるはずがない。
結論:
極めて幼稚な嘘、作り話、デタラメである。
パターン3の1
電子Aと電子Bのスピンを表わす関数をα(rA)β(rB)ーα(rB)β(rA)とする。
水素分子のφ={A(rA)+ B(rB)}{α(rA)β(rB)ーα(rB)β(rA)}
パターン3の2
電子Aと電子Bのスピンを表わす関数をα(σ1)β(σ2)ーα(σ2)β(σ1)とする。
(σ1, σ2はスピン1/2,-1/2を表すのだろう。)
水素分子のφ={A(rA)+ B(rB)}{α(σ1)β(σ2)ーα(σ2)β(σ1)}
(関数A()、 B()は定義されていない。)
(関数α ()、β()は定義されていない。)
結論:
極めて幼稚な嘘、作り話、デタラメである。
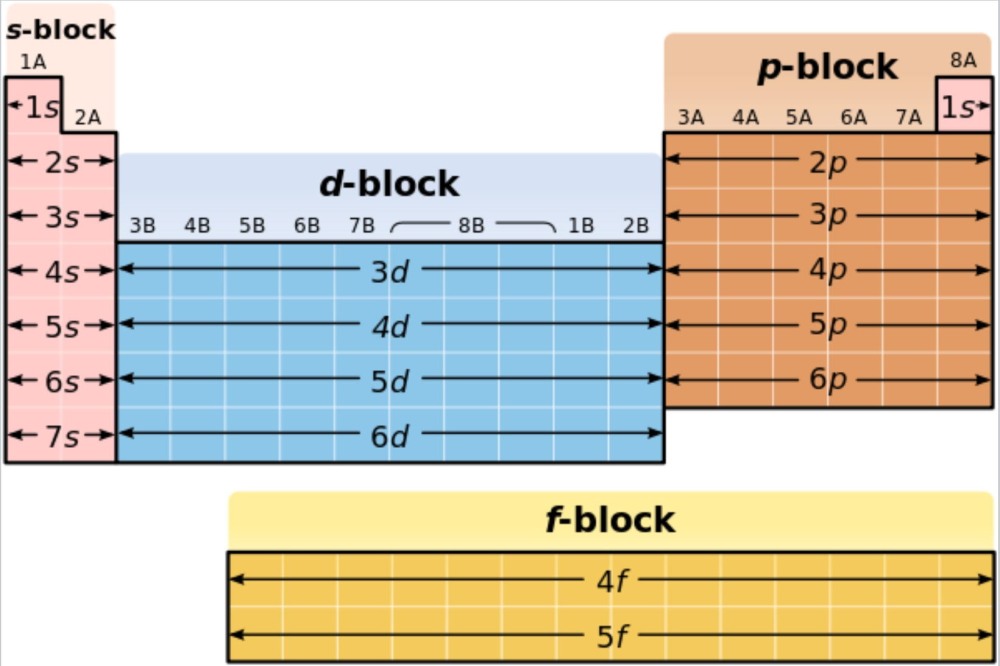
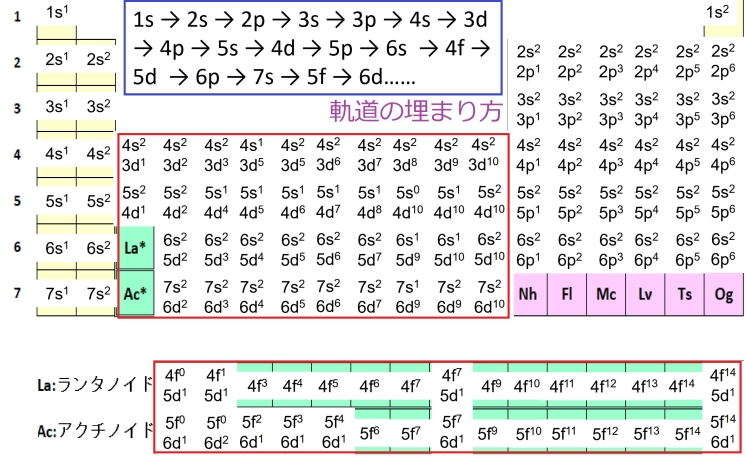
化学周期表を見ると分かる通り、S軌道、P軌道、D軌道、F軌道などが事実として使用され説明されている。
原子核に拘束される電子は非連続なエネルギー状態をとるとされる。
例えばS軌道にはS1,S2,S3…、P軌道にはP1、P2、P3…の軌道があるとされる。
電子には永久磁石の起源となるスピンとういう物理的性質があり、量子力学では上向きと下向きの二つの状態のみが存在するとされる。
複数の軌道が同じエネルギー準位となること。
P軌道は同じエネルギー状態で3軌道あるとされる。
d軌道は同じエネルギー状態で5軌道あるとされる。
「周期表ーWIKIPEDIA」
「周期表と電子軌道の詳細」
原子番号と化学的性質に規則性や周期性が存在するのは実験により確認されている事実である。ただし、d軌道やf軌道ではこの理屈は破綻している(図の赤い枠内)。
S軌道やP軌道、D軌道などの各電子軌道もエネルギー準位も水素原子のシュレディンガー方程式を根拠としている。
「量子力学 シュレディンガー方程式」で説明した通り、
従ってエネルギー準位という概念は嘘、偽り、デタラメである。
上記資料で説明した通り、エネルギー状態が自然に求まり、かつ整数n,m,lで表現されるというのが真実ならば物理学ではなく魔法である。当然に嘘、偽り、デタラメである。
化学周期表が量子化学で再現されるのは嘘、偽り、デタラメである。
原子や分子をパソコン内で構築、登録し仮想空間に配置し化学シュミレーションを実行可能なソフトウェアである。有名なソフトが4,5種類販売されている。
各ソフトで最も一般的で共通な事項を解説する。
などを求めたり再現可能とされる。
縮約ガウス関数
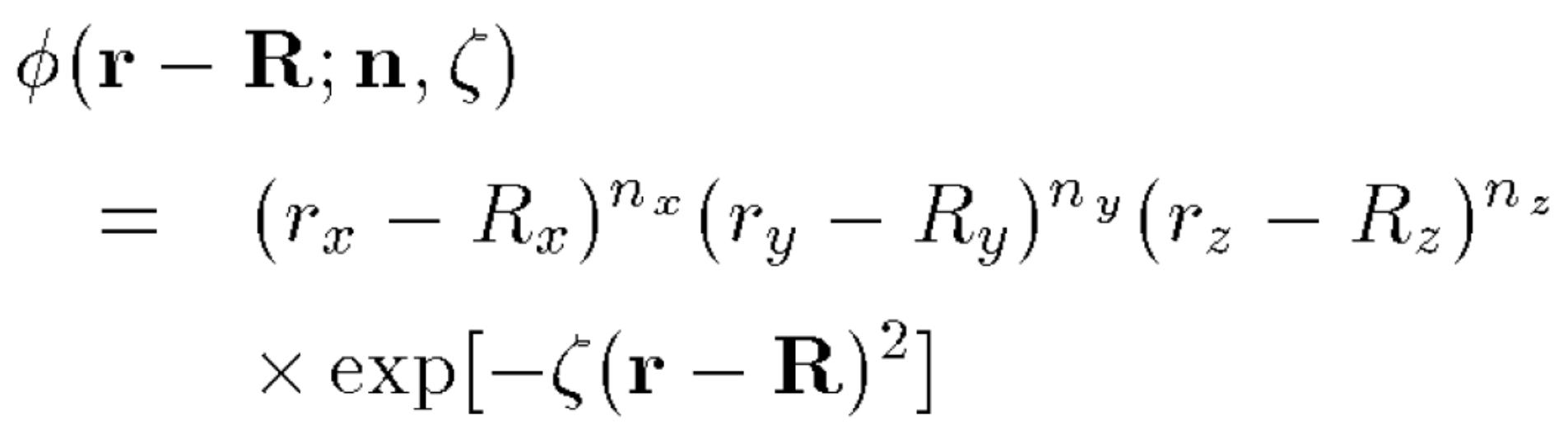
原子軌道積分
原子軌道の積を含む関数の積分である。
DFT計算
量子力学的計算の一種
AMBER力場
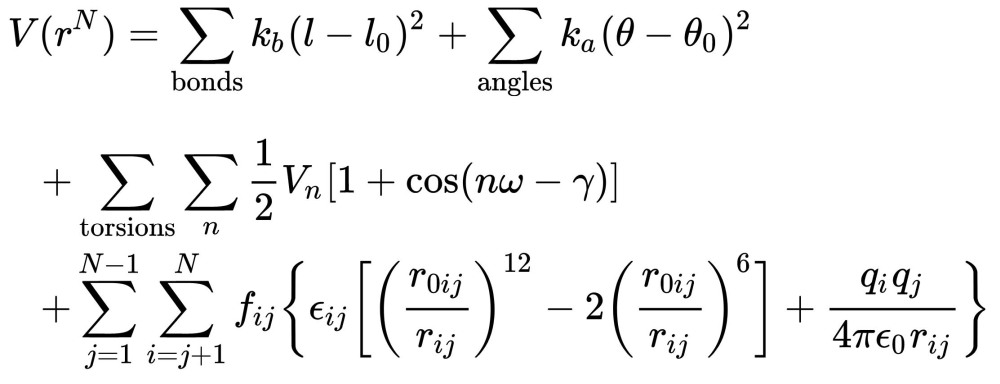
CNDO力場
半経験的分子軌道法量子化学計算
(半経験法や分子軌道計算では結合の概念が存在しない。)
MNDO力場
半経験的分子軌道法量子化学計算
(半経験法や分子軌道計算では結合の概念が存在しない。)
配置間相互作用
線形変分的ななハートリーフォック方である。
密度汎関数理論
電子系のエネルギーなどの物性を電子密度から計算することが可能であるとする理論である。
MCSCF法(多配置SCF法)
多電子励起電子配置の波動関数を求めておき、その線形結合時の係数のみを最適化するのに対し、この方法では同時に分子軌道も最適化する。
RHF法
両スピンが対を成して入るように計算の手続きを制限しているハートリー・フォック法。
CASSCF法
初期推測行列式において電子が最高占有軌道から与えられ,残りの軌道は活性空間を構築するのに必要なだけ初期推測行列式における最低仮想軌道として定義される。従って,閉殻系で4電子6軌道では,活性空間は下記のような構成となる:
位置r(x,y,z)に対して
φ=f(x,y,z)Exp(ーr)という関数形を取る。
これはf(x,y,z)がどの様な関数であろうとも位置rが大きくなるとExp(ーr)の項により急速にφが0に近づき、もっともらしく感じさせるからである。
量子力学は、我々が作成した資料「量子力学 シュレディンガー方程式」と「量子力学 行列力学」で説明した通り完全に物理学とは関係のない無意味な文字や記号の羅列でしかない。
量子化学シュミレーションはほぼ全て理論と計算式を量子力学を基に構成されており、直ちに正常な科学ではないと結論される。

水素原子、水素分子など全く再現不可能であり、その他の分子など再現できるはずがない。
水素原子、水素分子など全く再現不可能であり、化学反応を再現できるはずがない。
有機化学の実験および知見から普通原子の結合性電子は極小限定空間に決定論的に存在すると強く推測される。つまり電子の存在確立は嘘、作り話、デタラメである。
赤外吸収分光法(infrared absorption spectrometry, IR)とは、試料に赤外線をあてて得られる吸収スペクトルを測定する分析法である。特に有機化合物にどのような官能基が含まれるかを決定したい時に威力を発揮する。
分子の部分形状から、どのようなIRスペクトルが得られるかの情報が存在するが量子力学とは何の関係もない。
水素分子を全く何も再現不能であり振動を再現できるはずがない。
有機化学の実験および知見から電子は極小限定空間に決定論的に存在すると強く推測される。電子の存在確立概念は正しくなくポテンシャルエネルギーを正しく計算できない。
有機化学の実験および知見から電子は極小限定空間に決定論的に存在すると強く推測される。電子の存在確立概念は正しくなく分極率を正しく計算できない。
シュレディンガー方程式では核の座標を全く含まれず、また電子位置の認識も正常ではなく正常に核に働く力を計算できるとは考えられない。
波動関数は唯一解が求まるとされる水素原子ですら真実は解が求まらない、従って「波動関数の安定性」とは意味が理解不能である。
当然、物性論を再現などできるはずがない。
全て嘘、作り話、デタラメである。